

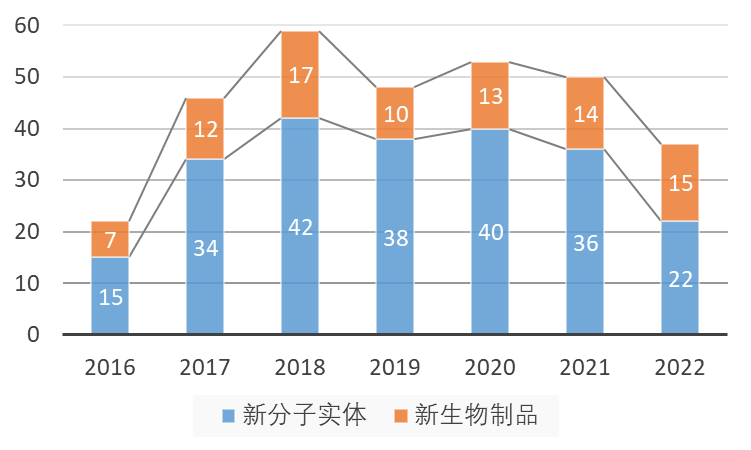
2022年是新冠疫情延续的第三个年头,疫情对新药创新活动的影响仍在持续,但美国食品药品监督管理局(FDA)的药物评价和研究中心(CDER)以及生物制品评价和研究中心(CBER)仍然批准了45种新疗法。其中,CDER批准了37种新药,是2017年以来最少的(图1),但其含金量却很高,生物制品的占比(41%)和抗体类药物的占比(30%)都达到了历史新高。
图1. 2016年以来CDER批准新药数
新疗法的活性类型(图2)包括小分子实体、核酸药物、细胞疗法、基因疗法、抗体药物等。其中的基于细胞的基因疗法、人粪便微生物群、双特异性细胞疗法等丰富了药品活性类型。
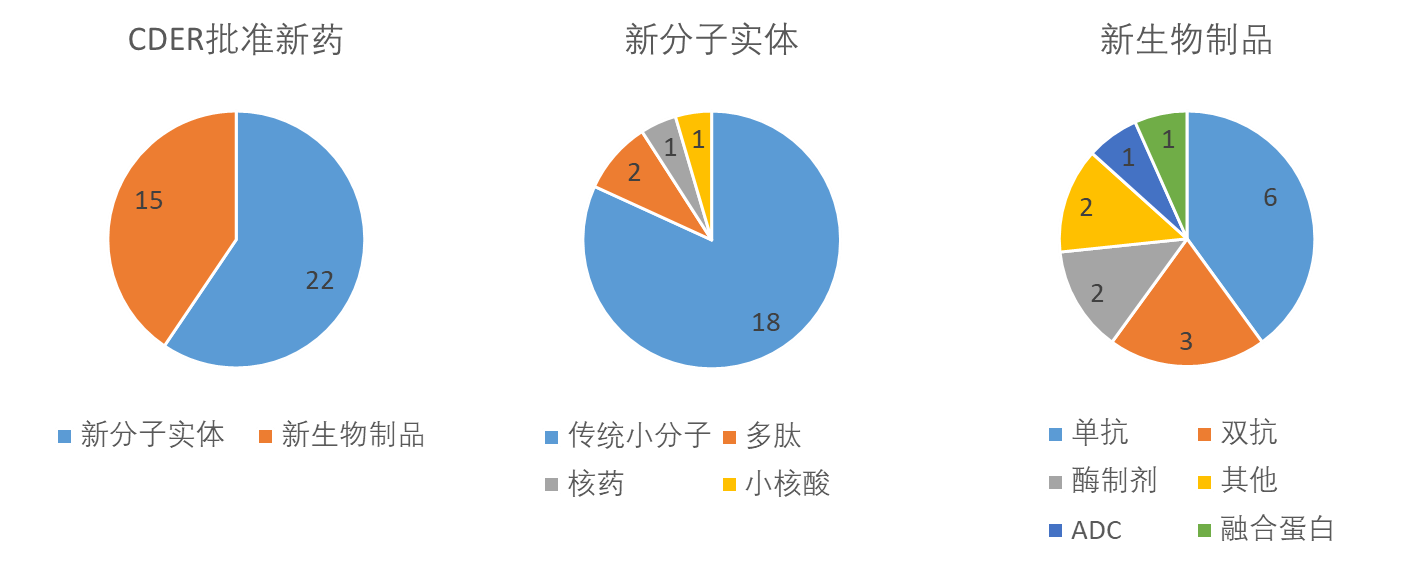
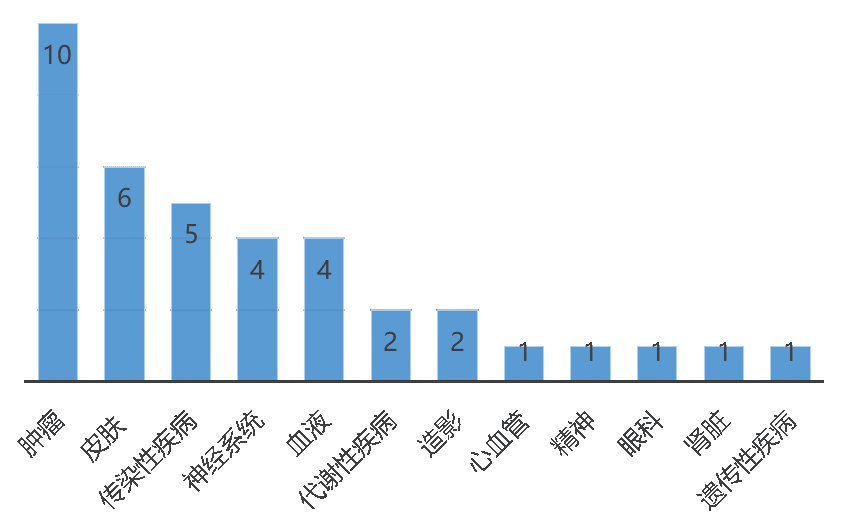
获批药物涉及广泛的治疗领域(图3),恶性肿瘤新药仍然占据首位,多种罕见疾病实现突破,获得孤儿药认定的新药共有20种。多款疫苗类产品的正式批准或紧急使用授权(EUA),既是生物技术进步的新成果,也是公共卫生性医疗产品研发受到重视的体现。
2022年新药的技术含量体现在多个方面。其中,有12种进入快速通道,21种获得优先审评资格,13种属于突破性疗法,6种临床急需又缺少有效疗法的新药通过加速审评获批。
(一)First in class(FIC):FIC新药是所有做药人追逐的目标。2022年有20种FIC药物获批,不仅仅在作用机制上创新,更在临床上显示突出的性能。典型代表有:
Camzyos (Mavacamten):胶囊剂,由Bristol Myers Squibb开发,是一种新型心肌肌球蛋白的小分子变构调节剂,可通过抑制肌钙-肌球蛋白结合,改善阻塞性肥厚型(HCM)心肌病患者的心功能。本品是HCM药物治疗的里程碑,目前这类患者的药物选择非常有限,本品成功给这种进行性、慢性疾病提供了全新的选择,但左室射血不足(LVEF<55%)患者,不推荐使用。
Mounjaro (Tirzepatide):注射剂,是礼来公司开发的第一个GLP1和GIP的双重激动剂,也是第一个拟GIP的药物。本品在几个临床试验中不仅表现出优秀的降血糖作用,还提供了剂量相关的减肥益处。被一些专家称为“迄今为止被批准用于治疗2型糖尿病最有效的药物”。本品对单纯性肥胖患者减肥效果的临床数据还在进一步分析,但超过2500名单纯肥胖或超重患者(指不伴有糖尿病)的实验数据显示,用药72周体重减轻15~21%,远超过安慰剂的3%,其减肥适应症可能会在2023年获批。基于这二项拥有庞大群体的适应症,该药物的全球峰值销售额可能达到108亿美元。
Pluvicto (Lutetium (Lu-177) vipivotide tetraxetan):注射剂,由诺华公司开发,是一种靶向前列腺特异性膜抗原(PSMA)的放射性配体疗法。本品在结构上属于偶联类药物,由靶向化合物(配体)与治疗性放射性核素组成,药物与表达PSMA的前列腺癌细胞结合,由Lu-177发出的β射线产生杀伤细胞杀伤效应。PSMA在超过80%的前列腺癌患者中高度表达,因此Pluvicto具有较高的选择性肿瘤杀伤效应,对周围健康细胞的损害较小。Pluvicto可以说是ADC类药物的扩展版,其payload是简单的核素原子,其制备工艺、质控都比大分子的毒素更简单。放射性核素偶联药物有望兴起。
Sunlenca (Lenacapavir):由Gilead Sciences开发,是HIV病毒衣壳蛋白抑制剂,Sunlenca是多靶点抑制HIV的药物,也是"first-in-class"衣壳抑制剂,对现有的其他药物类别没有交叉耐药性。本品作为第一个上市的长效艾滋病治疗药物,患者在完成Sunlenca的起始剂量后,每半年只要注射一次,即可维持治疗效果。长效药物代表了新型HIV感染治疗的未来方向。
Tzield (Teplizumab-mzwv):由Provention Bio开发,是一款靶向T细胞表面的抗CD3单克隆抗体,通过与效应T细胞表面的CD3结合,抑制T细胞对胰岛β细胞的攻击,从而保护胰岛β细胞不受破坏。用于延缓8岁及以上成人1型糖尿病由Ⅱ期向Ⅲ期的进展。Tzield是第一种获批用于该适应症的药物,也是第一个明确的延缓糖尿病进展的药物。本品需连续注射14天。本品的开发也历经坎坷。十多年前teplizumab在1型糖尿病患者中的3期临床试验失败,没有达到主要终点;在2019年,NIH赞助的一项针对76名有患病风险的个体的2期临床试验显示,该抗体将诊断1型糖尿病的中位时间推迟了约2年,基于这项临床结果,FDA在2021年召集其独立顾问评估时,以10比7的投票结果同意批准。
(二)6种临床急需又缺少有效疗法的新药通过加速审评获批。
Elahere (Mirvetuximab soravtansine-gynx):ImmunoGen开发的靶向叶酸受体α(卵巢癌细胞表面的一种蛋白质)的抗体药物偶联物,也是一种FIC。是FDA批准的首个用于铂耐药卵巢癌的ADC药物,用于治疗叶酸受体α(FRα)阳性且既往接受过1-3线全身治疗方案的铂耐药卵巢上皮性癌、输卵管癌或原发腹膜癌的成年患者。
Krazati (Adagrasib):Mirati Therapeutics开发,用于基因KRAS G12C突变的局部晚期或转移性非小细胞肺癌(NSCLC)患者,也是第二款针对KRAS G12C突变的药物,于2022年12月获得加速批准。FDA同时批准了QIAGEN therascreen公司的KRAS RGQ PCR试剂盒(组织),及Agilent Resolution ctDx FIRST Assay(血浆)作为Krazati的伴随诊断。如果在血浆标本中未检测到突变,则应检测肿瘤组织。
Lunsumio (Mosunetuzumab-axgb):基因泰克开发,是首个CD20 x CD3 T细胞结合双特异性抗体,用于治疗既往接受过至少2次系统治疗的复发或难治性滤泡性淋巴瘤(R/R FL)成人患者。本品2022年6月先在欧盟有条件批准上市,用于治疗复发或难治性(R / R)滤泡性淋巴瘤的成年患者。FDA 2022年12月加速批准。
Lytgobi (futibatinib):Taiho公司开发,2022年10月获得加速批准。用于接受过既往治疗、不可切除、局部晚期或转移性晚期胆管癌的成年患者。它被批准用于治疗具有FGFR2基因融合或其他重排的肝内疾病患者。FGFR是胆管癌最常见的突变类型之一,主要有四个重要基因型(FGFR1、FGFR2、FGFR3和FGFR4)。其中FGFR2是最常见的亚型,其在胆管癌中的检出率接近10%。Futibatinib是一种高效的选择性FGFR1-4抑制剂,与ATP竞争性FGFR抑制剂不同,它可以与FGFR激酶结构域P环中的保守半胱氨酸共价且不可逆地结合,这就意味着Futibatinib与其他FGFR抑制剂治疗相比,出现更少的耐药问题。本品的临床试验也表现出优异的效果,作为全球第四种胆管癌新药,其全新的作用机制给胆管癌患者带来了新的福音。
Tecvayli (teclistamab-cqyv):由强生公司开发,用于治疗复发或难治性多发性骨髓瘤的成年患者。Tecvayli是一种首创的双特异性T细胞接合抗体,用于治疗先前接受过四线或更多种治疗的患者。Tecvayli是第一个被批准用于治疗多发性骨髓瘤(MM)的双特异性抗体疗法(BCMAxCD3)。Tecvayli是一种即用型(off-the-shelf,也即可以直接在货架上购买)产品,通过皮下注射给药。这给患者带来极大的便利,也是细胞治疗产品的发展方向。它于2022年10月获得加速批准。
Vonjo (pacritinib):CTI BioPharma开发,用于骨髓纤维化(一种骨髓癌),伴低血小板患者。这是首款针对成人细胞减少骨髓纤维化治疗的JAK激酶抑制剂,对JAK2和IRAK1具有特异性,不抑制JAK1。
(三)小分子实体的技术突破。在新活性类型不断涌现的同时,传统的小分子实体在新技术加持下,2022年也涌现突破性的进展。
Deucravitinib:百时美施贵宝(BMS)开发的第一个TYK2抑制剂,第一个假激酶结构域的抑制剂,也是第一个从头氘代的上市药物。单个药物分子涵盖三个第一,这是真正的强研发实力体现!本品目前批准的临床适应症是牛皮癣,BMS还在开发用于其他适应症,包括银屑病关节炎和系统性红斑狼疮。该药的峰值销售额可能达到近17亿美元。作为第一个从头氘代的药物,本品的成功将新药分子设计从原子尺度推进到电子尺度,预示着高精度的靶点结构信息,将成为新药设计的核心技术。
Relyvrio (AMX0035):Amylyx的二种简单小分子——苯丁酸钠+牛磺酸二醇的固定剂量复方制剂,用于治疗致命的运动神经元疾病肌萎缩侧索硬化症(ALS)。这种疗法的作用机制尚不清楚,Amylyx推测是通过减轻内质网应激和线粒体功能障碍来预防神经元死亡。由于作用机制不明确,审批过程一波三折。2020年,该药物在177名ALS患者中进行的2期试验结果表明,在肌萎缩侧索硬化症功能评定量表修订版(测量身体功能)上,它比安慰剂提供了一些益处。2021年夏天,FDA批准治疗阿尔茨海默病的第一种降低淀粉样蛋白药物,受到巨大压力,对Amylyx的药物进行了审慎的审查。FDA召集其独立顾问在2022年期间两次讨论该药物,结果各不相同。3月,小组成员以6比4的投票结果认为,数据没有显示该治疗对ALS有效。在对实验数据深入分析之后,该小组于9月再次召开会议再次讨论数据时,以7比2投票同意该药物的功效。
(四)在CDER的新品不断取得突破的同时,CBER批准的产品也亮点颇多,一些基因疗法的价格,更是不断刷新人们的想象。典型品种有:
Carvykti (ciltacabtagene autoleucel;cilta-cel):由国内传奇生物自主研发的CAR-T细胞疗法,由杨森生物技术公司推广销售,用于治疗复发或难治性多发性骨髓瘤患者。Carvykti是一种靶向B细胞成熟抗原(BCMA)的嵌合抗原受体T细胞(CAR-T)疗法,使用嵌合抗原受体(CAR)的转基因对患者自身的T细胞进行修饰,以识别和消除表达BCMA的细胞。2022年FDA曾拒绝两种由国内公司开发的PLD1阻滞剂——礼来/信达生物的Sintilimab和Coherus的toripalimab。Carvykti的成功提振了国内生技公司走向世界的信心。
Hemgenix (etranacogene dezaparvovec-drlb):CSL Behring开发,是第一个针对成人B型血友病的一次性基因疗法。AAV5载体携带因子IX的Padua基因变体(FIX-Padua)至肝脏中的靶细胞,生成比正常活性高5x-8x的因子IX蛋白。它的标价为350万美元,是新药有史以来最高的价格。Hemgenix对B型血友病的疗效显示了基因疗法的巨大潜力,但其高昂的价格也给国内的生物技术公司创投替代品提供了机会。2022年11月获得批准。
Rebyota (fecal microbiota, live-jslm):Rebiotix开发,Reybota是一种单剂量灌肠剂,由供体粪便中提取的肠道细菌样本制成,旨在恢复人体肠道中的微生物群的平衡,用于预防18岁及以上人群在对复发性艰难梭菌感染(CDI)进行抗生素治疗后复发。本品是有史以来第一个防止CDI复发的微生物群产品,也是第一个人粪便制备的药用产品。这对目前已经火热的“肠道菌群”健康理念是一针强心剂。实际上这类产品的开发仍有多项技术挑战,本品作为研究用治疗品,2013年已经得到FDA的批准,直到2022年才正式批准上市。
Skysona (elivaldogene autotemcel,Lenti-D):Bluebird Bio开发,是目前首个治疗携带ABCD1基因突变,导致儿童期神经发育不良,甚至死亡的一种基因疗法。ABCD1基因突变,引起肾上腺脑白质营养不良(ALD),这是一种罕见的X染色体连锁代谢疾病,主要影响男性。本法可以减缓患有早期活动性脑肾上腺脑白质营养不良(CALD)的男孩的神经功能障碍的进展。它于2022年9月获得FDA加速批准。虽然治疗价格高达300万美元,但疗效确切,也别无选择。欧盟于2023年1月也批准其上市。
Zynteglo (betibeglogene autotemcel,beti-cel):是基于bluebird bio的LentiGlobin平台开发的慢病毒基因疗法,是首款基于细胞的基因治疗产品。首先从患者骨髓中提取造血干细胞,然后通过慢病毒将β-珠蛋白基因的修饰形式的功能性拷贝添加到患者自身造血干细胞中,恢复血红蛋白生成。作为首个“地贫”基因疗法,早在2019年就获得欧盟批准。本疗法的价格也高达280万美元。