

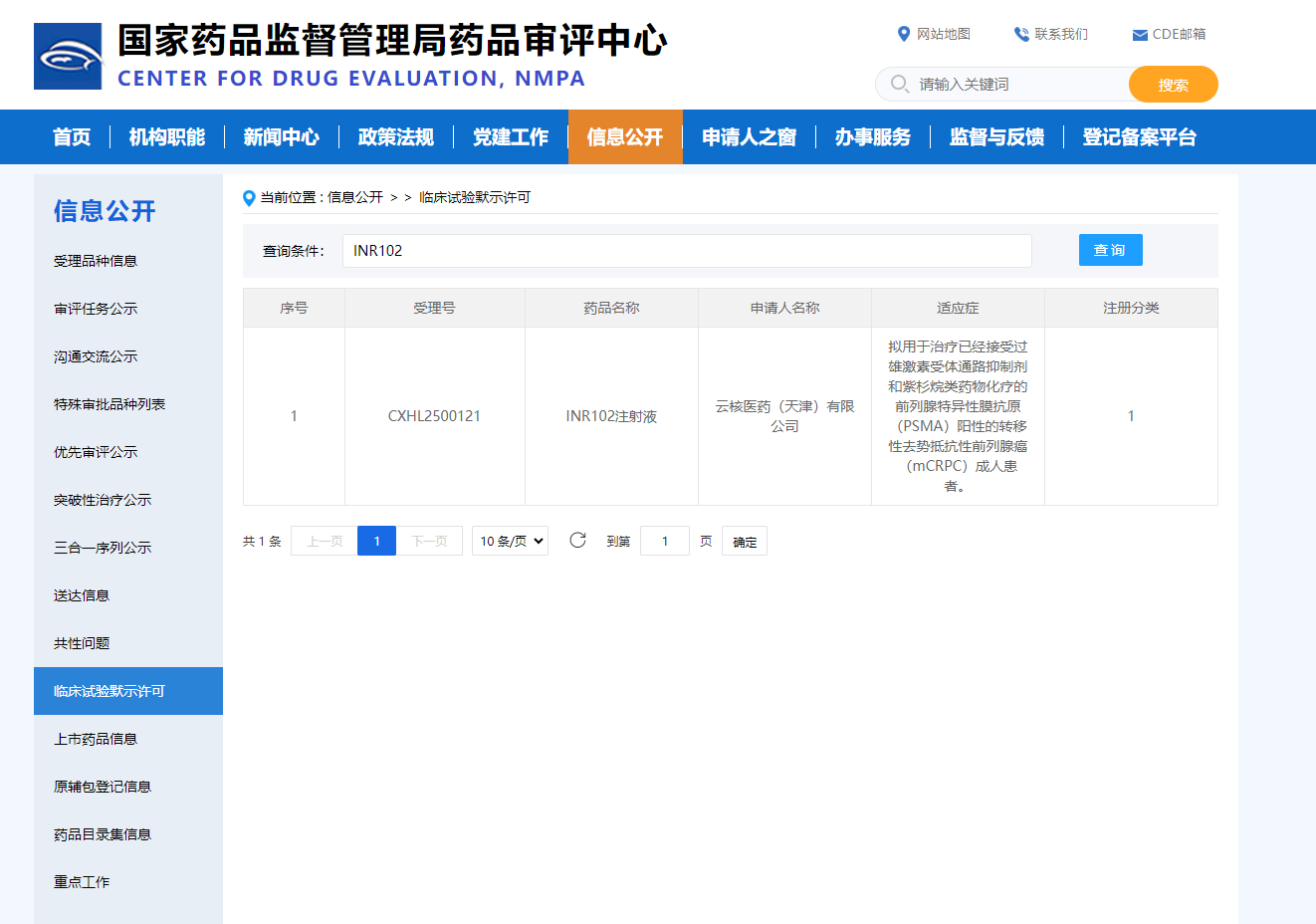
根据国家药品监督管理局(NMPA)官网信息,云南白药全资子公司云核医药取得重大进展,其自主研发的化学1类放射性治疗类创新药产品INR102注射液正式获得国家药监局批准,可用于前列腺癌的临床试验。这标志着云核医药在放射性治疗领域的创新性治疗方案迈出了重要一步。
作为项目的核心实验合作伙伴,天诚新药高效完成了包括药物相互作用等药代动力学等关键研究工作,为项目顺利获批提供了有力支持。这也是天诚新药评价在支持创新药研发方面的又一成功案例。
INR102注射液是云核医药自主研发的一款放射性治疗类药物,旨在为前列腺癌患者提供更有效、更精准的治疗选择。天诚新药以专业的技术平台和高效的服务,助力云核医药实现了这一重要里程碑的达成,为中国放射性治疗领域的发展贡献了力量。
天津天诚新药评价有限公司可承接并开展符合国内外申报要求的体外药物相互作用研究,具体内容如下:
1 代谢介导的药物相互作用评价
(一)酶表型研究
(二)酶抑制研究
(三)酶诱导研究
2 转运体介导的药物相互作用评价
我司自有多种转运体稳转细胞系和同位素资质实验室,实验体系稳定可靠,遵循国内外技术指南。对于特殊转运体,也可以定制顺转/稳转细胞系用于实验。
(一)评价药物是否为转运体的底物
(二)评价药物是否为转运体的抑制剂
遵循的国内外技术指南包括:
[1]国家药品监督管理局药品审评中心 药物相互作用研究技术指导原则(试行) 2021年
[2]ICH协调指导原则 药物相互作用研究 M12 2024年
[3]FDA CDER In Vitro Drug Interaction Studies-Cytochrome P450 Enzyme-and Transporter-Mediated Drug Interactions 2020
[4]EMA CHMP Guideline on the investigation of drug interactions 2013